什么是慢病毒滴度?
主流的慢病毒滴度检测方法概览
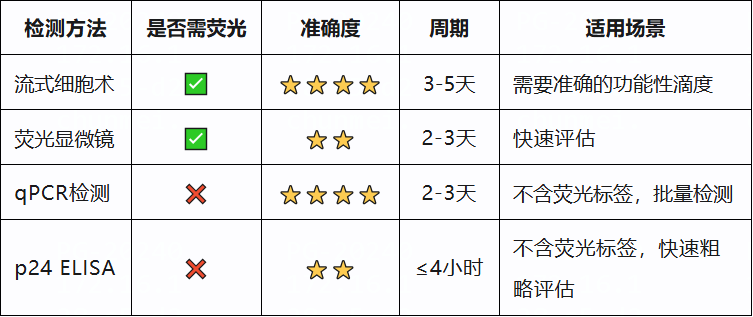
主流的慢病毒滴度检测方法全解析
1. 流式细胞术检测法(FACS)
原理:利用流式细胞仪检测表达荧光报告基因(如GFP或RFP)的阳性细胞比例,计算活性病毒滴度。
操作流程:
- 将细胞接种到培养板中(通常为HEK293T细胞);
- 制备病毒梯度稀释液(如10^-1至10^-6);
- 用不同浓度的病毒稀释液感染细胞;
- 感染48-72小时后收集细胞;
- 流式细胞仪分析阳性细胞比例。
根据公式计算滴度:TU/mL = (阳性细胞比例 × 细胞数量) / 病毒用量(mL) × 稀释倍数[1]。
优势:
- 只计数功能性病毒颗粒,能准确反映病毒实际感染能力;
- 数据重复性好;
- 高通量分析[2]。
局限性:
- 需要病毒载体携带荧光报告基因;
- 仪器要求高,成本较高;
- 操作相对复杂,周期较长(3-5天) [3]。
2. qPCR法(定量PCR检测)
原理:通过定量PCR检测整合到宿主细胞基因组中的病毒特定序列(如WPRE元件)拷贝数,推算活性病毒滴度[4]。
操作流程:
- 用病毒感染靶细胞;
- 培养48-72小时后提取细胞基因组DNA;
- 设计针对病毒特定序列的引物(如WPRE)和内参基因(如白蛋白基因);
- 进行qPCR反应,并与标准品比较;
- 计算每个细胞中整合的病毒基因组拷贝数;
- 换算为病毒滴度。
换算方法:每个细胞的慢病毒拷贝数 =(WPRE 拷贝数/Alb 拷贝数)× 2;
滴度(TU/ml)=(第 1 天的细胞初始数量 × 样本的每个细胞的慢病毒拷贝数)/ 使用的慢病毒体积(ml)。
优势:
- 适用于不带荧光标记的病毒;
- 检测灵敏度高;
- 操作相对标准化;
- 定量准确。
局限性:
- 需要专业qPCR设备和经验;
- 标准曲线建立要求高;
- 可能受DNA提取效率影响;
- 检测时间约24-48小时[5]。
3. p24蛋白ELISA检测法
原理:通过ELISA技术检测慢病毒颗粒中p24核心蛋白的含量,间接计算病毒颗粒数量[6,7]。
操作流程:
- 在微量滴定板上加入病毒样品;
- 添加p24捕获抗体进行孵育;
- 加入生物素标记的p24二抗;
- 添加HRP标记的链霉亲和素;
- 加入底物显色并检测吸光度;
- 通过标准曲线计算p24含量和病毒滴度
优势:
- 操作简便快捷(约4小时可完成);
- 不依赖荧光报告基因;
- 重复性好;
- 设备要求低。
局限性:
- 检测的是物理颗粒数而非功能性病毒;
- 游离p24蛋白可能导致滴度偏高;
- 与实际感染能力相关性较低;
- 成本相对较高[8]。
4. 荧光显微镜计数法
原理:通过荧光显微镜直接观察和计数表达荧光蛋白的阳性细胞,估算病毒滴度[9]。
操作流程:
- 将病毒进行梯度稀释并感染目标细胞;
- 培养48-72小时;
- 荧光显微镜下观察计数阳性细胞
计算公式:TU/mL = 阳性细胞数 × 稀释倍数 / 感染体积(mL)
优势:
- 设备要求较低;
- 可直观观察细胞形态和感染情况;
- 适合初步评估或小规模检测;
- 操作相对简便。
局限性:
- 统计效率低,样本量受限;
- 主观因素影响大;
- 精确度和重复性较低;
- 需要荧光报告基因[1]。
检测方法选择建议
当需要准确的功能性滴度时:推荐流式细胞术检测法,尤其是对于携带荧光报告基因的病毒。
当病毒不含荧光标记时:考虑qPCR法或p24 ELISA检测法。
当需要快速初步评估时:可选择p24 ELISA或荧光显微镜法。
当需要进行批量检测时:流式细胞术和qPCR法更适合高通量分析。
滴度检测中的常见问题与解决方案
1. 不同方法测得的滴度差异大
原因:各检测方法原理不同,检测的对象也不同。
解决方案:建议实验室内部选定一种方法并坚持使用,保持数据一致性。
解决方案:避免反复冻融(每次冻融会降低约50%滴度);-80°C保存;优化感染条件。
3. 检测结果重复性差
原因:操作不标准、细胞状态不一致等。
解决方案:标准化操作流程;使用状态良好的细胞;设置多个重复。
4. 检测周期长
原因:病毒感染和基因表达需要时间。
解决方案:根据紧急程度选择合适方法;p24 ELISA最快(4小时),但精确度较低。
发展趋势与新技术
随着基因治疗领域的快速发展,慢病毒滴度检测技术也在不断创新:
数字微滴PCR技术(ddPCR):比传统qPCR更精确,无需标准曲线,可直接定量[10]。
表面增强拉曼光谱(SERS):通过检测病毒颗粒的拉曼光谱特征快速测定滴度[11]。
荧光显微镜与干涉仪结合:同时测定滴度、结构和污染物水平[12]。
我们的专业服务
作为专业的基因治疗服务提供商,我们公司提供全方位的慢病毒包装和滴度检测服务:
高效包装技术:采用优化的三质粒系统,产出高滴度病毒(通常>10^8 TU/mL)。
多种滴度检测方法:提供流式细胞术、qPCR和p24 ELISA等多种检测方法。
全面的质控体系:包括滴度检测、内毒素检测、无菌检测等。
定制化服务:根据您的实验需求提供个性化方案。
技术支持:专业团队提供技术咨询和实验优化建议。
[1] MD Anderson. Lentivirus titering protocol. Technical Manual. 2022.
[2] Mekkaoui L, et al. Optimised Method for the Production and Titration of Lentiviral Vectors Pseudotyped with the SARS-CoV-2 Spike Protein. Bio Protoc. 2021;11(16):e4194.
[3] Geraerts M, et al. Comparison of lentiviral vector titration methods. BMC Biotechnol. 2006;6:34.
[4] Barczak W, et al. Universal Real-Time PCR-Based Assay for Lentiviral Titration. Mol Biotechnol. 2014;57:195-200.
[5] Addgene Blog. Tips for Titering Your Lentiviral Preps. 2022.
[6] Sigma-Aldrich. Lentiviral Titer via p24 (viral coat protein) ELISA Assay. Protocol. 2022.
[7] OriGene. Lenti titer kit p24 ELISA manual. Technical Manual. 2023.
[8] Li T, et al. High-precision lentivirus titer determination and protein profiling. SCIEX Technical Note. 2023.
[9] Addgene. Fluorescence Titering Assay for Lentivirus. Protocol. 2022.
[10] Kandell J, et al. Universal ddPCR-based assay for the determination of lentivirus infectious titer and vector copy number. Mol Ther Methods Clin Dev. 2023;30:273-283.
[11] Morder CJ, et al. Determination of Lentiviral Titer by Surface Enhanced Raman Spectroscopy. Sci Rep. 2022;12:5672.
[12] Unchained Labs. Pair up lentiviral titer and structure with Leprechaun. Application Note. 2023.
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。