腺相关病毒(AAV)是基因治疗中应用最广泛的病毒载体之一,因其高效性、安全性和低免疫原性而备受青睐。AAV能够感染细胞,其基因组以游离环状DNA的形式长期存在于细胞核内,整合到宿主基因组的频率极低,其衣壳蛋白序列决定了它们的组织特异性,不同血清型结合不同的细胞表面糖类和相关受体。但AAV的生物学特性仍有待深入研究,尤其是如何提高其组织靶向性和递送效率。
来自Baylor College of Medicine的William R. Lagor团队在2025年3月于Molecular Therapy上发表题为“A comprehensive atlas of AAV tropism in the mouse”的文章,该研究通过系统性注射荧光报告基因载体,全面分析了10种天然AAV血清型在雄性和雌性小鼠22种组织中的分布和转导效率,发现了AAV4可高效转导血管内皮细胞和胰腺β细胞。为基因治疗研究提供了重要的AAV图谱,有助于优化血清型选择并拓展新的治疗靶点。

首先,作者选取了10种具有衣壳序列多样性且具备重要临床前/临床相关性的天然AAV血清型(AAV3b、4、5、6、7、8、9、rh8、rh10和rh74),通过尾静脉注射方式向野生型小鼠递送双荧光报告载体,可分别检测即时转导(ZsGreen)和特异性(tdTomato)。实验设置4-6只/性别组以分析性别差异,注射4周后收取22种器官,通过荧光成像和DNA分离定量评估AAV基因组分布与转导效率,为系统解析不同血清型的组织靶向性提供了数据。(图1)
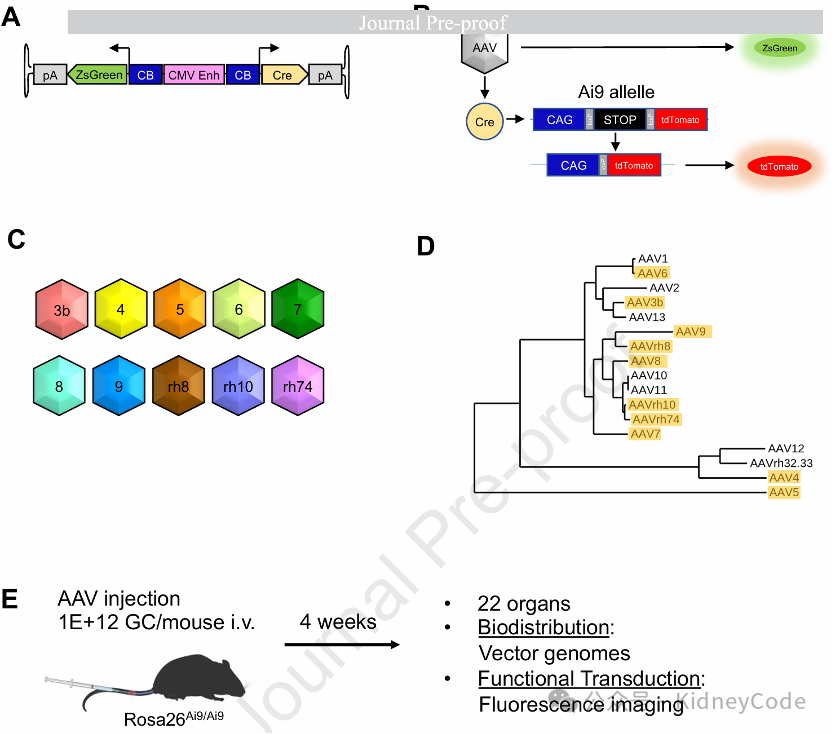
图1 小鼠AAV趋向性调查分析的实验设计
其次,作者通过qPCR检测各器官样本中的病毒基因组拷贝数发现,经静脉注射后,大多数AAV血清型在雄性和雌性小鼠肝脏中均表现出最强的递送,同时在肾、腓肠肌、膈肌、心脏和皮肤中也检测到显著的载体基因组。AAV3B表现出整体低转导效率且不靶向肝脏,而AAV4则特异性靶向肺组织,AAV8在膀胱中最有效。值得注意的是,性别差异显著:AAVrh10在雄性小鼠中总载体量最高且在70%的器官中占优,而雌性小鼠中AAVrh74的递送效果最佳。此外,雄性小鼠肝脏转导效率普遍高于雌性。 (图2)
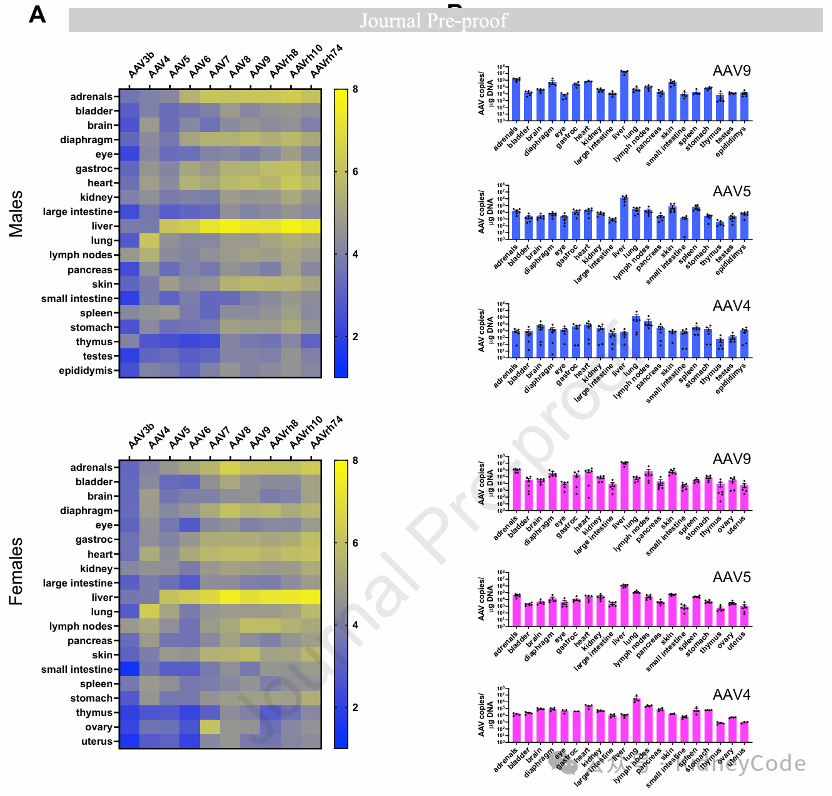
图2 10种AAV血清型在22种不同组织中的生物分布
代表性器官成像显示:1)肝脏中除AAV3B/4外多数血清型转导强;2)肾皮质区转导显著而髓质几乎无信号,体现器官内区域特异性;3)胸腺等低转导组织中仍可检测到零星tdTomato+细胞。生殖器官分析表明,所有血清型仅靶向睾丸间质细胞和卵巢髓质区体细胞,未检测到生精小管或卵泡内生殖细胞转导。而子宫等组织虽病毒载量低但tdTomato+细胞比例较高,而脾脏、胸腺和淋巴结呈现非特异性转导,可能与免疫器官特有的启动子沉默或降解机制有关。(图3)
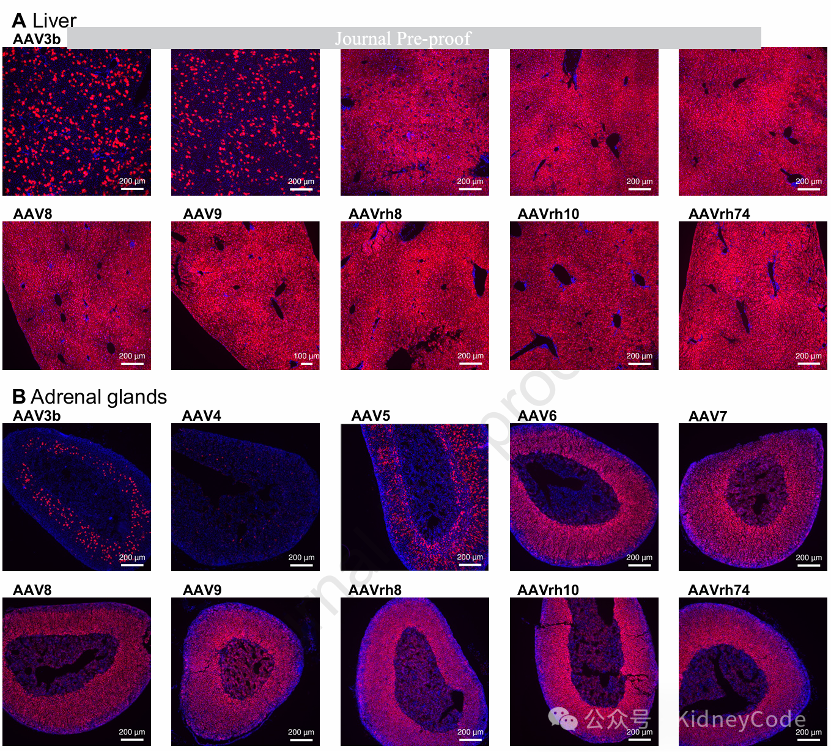
图3 荧光成像检测转导效率
AAV4展现出与其他血清型截然不同的特征:肝脏转导效率极低,但对肺组织具有高度特异性。流式分析揭示其转导的肺细胞中超过85%为内皮细胞,显著高于非内皮细胞的转导率。进一步研究发现,AAV4具有广谱血管内皮靶向能力,在胃、膀胱、肾上腺、胰腺、脑、小肠、胸腺等多种器官中均检测到清晰的tdTomato+内皮细胞信号,甚至在视网膜中也表现突出。此外,AAV4对胰腺胰岛β细胞具有特异靶向性,而其他血清型,如AAV8/5虽也能转导胰岛但特异性较差。这些发现确立了AAV4作为内皮细胞和β细胞基因递送的高效工具,为血管相关疾病和糖尿病基因治疗提供了新策略。(图4)
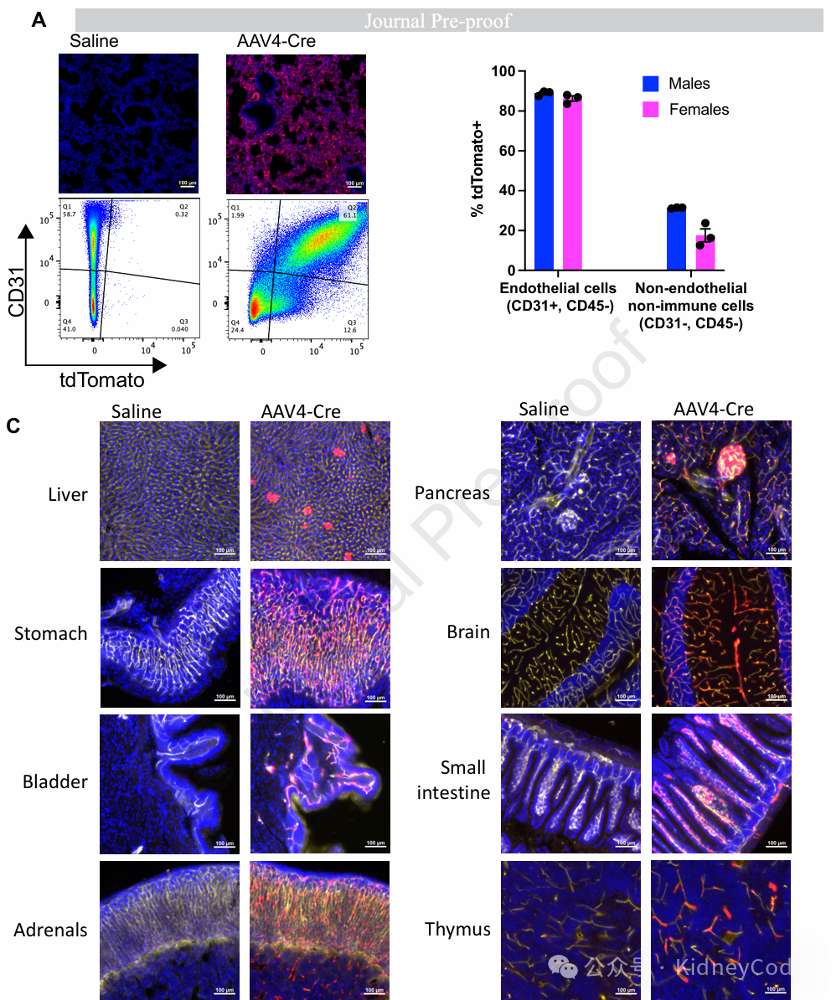
图4 AAV4对内皮细胞和胰腺β细胞表现出特异性
文章结论与展望
转自:KidneyCode
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。