在生命科学研究与药物开发领域,动物模型是揭示人类疾病机制、筛选药物靶点以及评估新药疗效与毒性的重要工具。随着分子生物学技术的不断发展,基因工程技术在动物模型构建中的应用日益广泛。腺相关病毒(Adeno-associated virus,AAV)凭借其高效、安全、低免疫原性以及长期稳定表达等特性,已成为当前基因治疗及动物模型构建中备受关注的重要载体之一。
传统构建动物疾病模型的方法主要包括:
- 转基因动物:通过原核显微注射技术将外源基因随机或定点整合到胚胎基因组中
- 化学诱导:使用特定的化学物质诱发疾病表型。
- 手术造模:通过外科手术方式模拟疾病状态。
- 自发性疾病模型:利用自然突变或特定品系的动物。
这些方法存在周期长、成本高、操作复杂、成功率不稳定等问题,且很难实现时空特异性地调控目标基因表达。
AAV在动物造模中的优势
相较于其他病毒载体,AAV在动物模型构建中展现出以下显著优势:
- 周期短:制备转基因动物的周期长(食蟹猴和恒河猴,一般3岁开始青春期,4-5岁性成熟,妊娠期为5-6个月),用AAV构建疾病动物模型周期更短。
- 成本低:AAV载体的构建和生产技术较为成熟,可降低动物造模的前期投入;AAV 造模通常对动物品系的限制较小,且由于其感染效率高、作用稳定等特点,能在较小的动物样本量下获得可靠的实验结果,进一步减少了实验动物的使用数量和相关成本。
- 操作简便快捷:可通过多种途径实现快速递送,如尾静脉注射、脑内注射、玻璃体腔注射等,适用于不同组织和器官的模型构建。
- 基因表达稳定且持久:AAV介导的基因在动物体内可实现持续数月甚至数年的稳定表达,特别适合用于慢性疾病的模型构建。
- 安全性高:AAV本身无致病性,且免疫原性极低,可支持多次注射,降低了因免疫反应导致的实验干扰。
- 组织特异性表达能力强:不同血清型的AAV具有不同的组织亲和性。例如,AAV9能够穿透血脑屏障,适用于中枢神经系统相关疾病的模型构建。
AAV在动物造模中的应用
AAV病毒凭借其安全性、靶向性和灵活性,已成为动物模型构建的核心工具。从帕金森病到乙肝感染,从动脉粥样硬化到神经退行性疾病,AAV不仅推动了基础研究的深入,更加速了临床转化进程。未来,通过技术创新与跨学科融合,AAV有望在精准医学和基因治疗中发挥更广泛的作用,为人类疾病研究开辟新纪元。
1. AAV构建乙肝病毒感染模型
乙肝病毒宿主范围狭窄,传统的树鼩和黑猩猩模型存在重复性差、稳定性低、感染率低等问题。而小鼠缺乏HBV受体,无法直接感染。AAV载体为解决这一困境提供了创新方案。
AAV-HBV模型构建方法
利用AAV8的高嗜肝性特点,构建携带1.3拷贝HBV全长基因组的AAV载体(rAAV-HBV1.3-mer WT replicon),通过尾静脉注射导入小鼠肝脏,实现长期稳定感染。
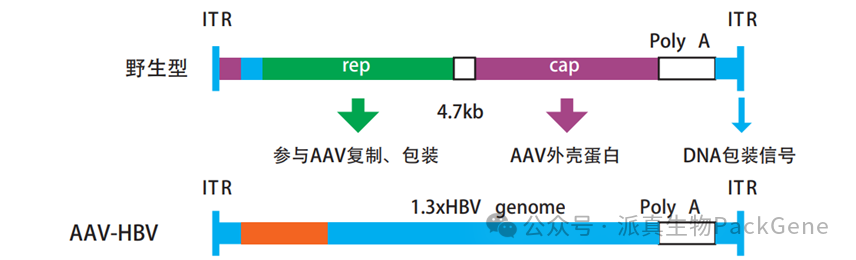
AAV-HBV质粒示意图
AAV-HBV模型优势
- 注射后3-4天即可检测到乙肝病毒标志物。
- 表达持续时间长(7周以上)。
- 实验结果稳定。
- 剂量-效应关系明确。
- 安全性高。
案例分享
厦门大学夏宁邵院士团队在Advanced Science杂志发表题为“A Dual-domain Engineered Antibody for Efficient HBV Suppression and lmmune Responses Restoration”的研究论文,首次报道了一种新型的Fab和Fc双域工程化抗体。在用AAV-HBV构建的慢性乙肝感染小鼠模型中,用原始抗体十分之一剂量即可有效抑制HBV复制,增强机体免疫反应, 这项研究为开发基于抗体的高载量慢性病毒感染治疗奠定了基础。
2. AAV构建帕金森病模型
传统PD模型通常使用神经毒素如MPTP、6-OHDA等化学诱导,但这些模型难以完全模拟疾病进程。AAV介导的基因递送提供了更接近人类疾病的分子机制模型。
通过脑立体定位将AAV注射至特定脑区(如黑质或纹状体),介导α-synuclein过表达或诱导多泛素蛋白降解系统异常,形成类似人类PD的神经元变性和行为异常。
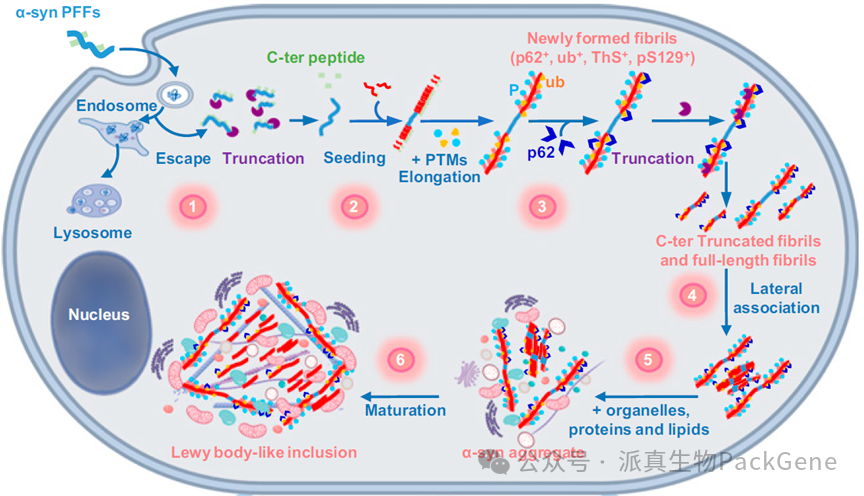
α-Syn形成路易小体的机制示意图 Mahul-Mellier et al., PNAC.2020
- 具有更高的安全性,无毒且注射剂量低。
- 表达持续时间长,可以更好地模拟帕金森病发生的全过程。
案例分享
暨南大学粤港澳中枢神经再生研究院的杨伟莉、李世华及李晓江团队在发表题为“Deficiency of Parkin causes neurodegeneration and accumulation of pathological α-synuclein in monkey models”的研究论文。研究团队通过AAV介导的基因编辑技术构建了Parkin基因缺失猴模型,确定了Parkin磷酸化是帕金森病发病的关键因素,为帕金森病的发病机制和潜在治疗方案提供了新视角。
3. AAV介导的阿尔茨海默病模型
在阿尔茨海默病(AD)的病程中,胆碱能神经元的退化是致使痴呆出现的关键病理因素之一。传统构建动物模型的主要方式是模拟该病理机制下的胆碱能神经功能损伤,常见手段涵盖物理损伤以及化学药物损伤等类型,物理损伤造模操作难度大且病理特征局限,化学药物损伤造模缺乏特异性。而AAV凭借其能在不同核团内实现特异性表达的特性,在探究 AD 临床症状所关联的环路机制方面意义重大。
AAV-AD模型构建方法:
将编码人APP或Tau蛋白的AAV载体直接注射到实验动物的海马区,使得APP或Tau蛋白在神经元中表达,最终表现出与AD患者相似的病理特征。
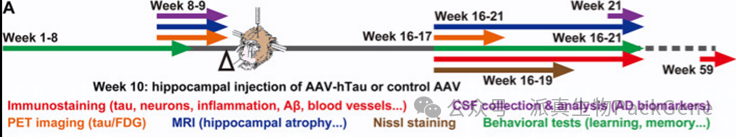
脑立体定位将AAV注射至双侧海马体获得tau持续高表达的NHP模型 Jiang Z, et al.Alzheimers Res Ther. 2024
案例分享
暨南大学陈功/雷文亮团队发表的一篇题为“A nonhuman primate model with Alzheimer’s disease-like pathology induced by hippocampal overexpression of human tau”文章,为AD研究带来了新突破。研究团队通过在非人灵长类动物(NHPs)中单次注射AAV,成功地过表达人类tau蛋白,建立了AD病理模型,为研究AD的机制和开发治疗方法提供了新的可能性。
4. AAV诱导动脉粥样硬化模型
动脉粥样硬化(atherosclerosis,AS)是多数心血管疾病的根源,传统造模法如高脂饮食诱导、基因敲除/敲入存在建模周期长、难以模拟后天因素致病等局限。而AAV作为一种安全高效的基因转导工具,凭借系统注射或靶向递送的优势,可精准调控动物体内特定基因的表达、沉默或编辑,从而有效用于AS模型的诱导与构建。
AAV载体携带PCSK9突变体,通过静脉注射或尾静脉注射进入肝脏,抑制LDLR表达,诱导高胆固醇血症,进而形成AS。
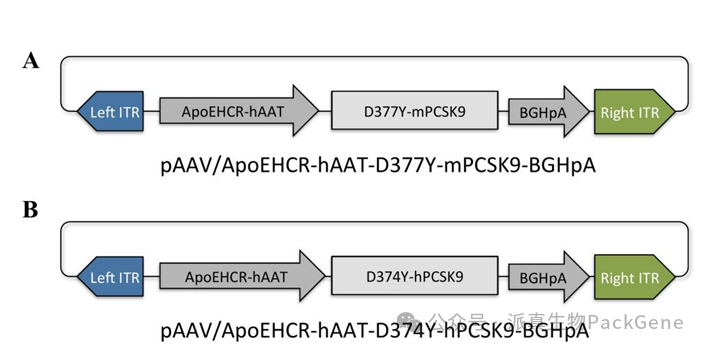
pAAV-PCSK9质粒示意图 Bjørklund MM, et al.Circulation Research. 2014
案例分享
Bjørklund MM等人在Circulation Research发表题为“Induction of atherosclerosis in mice and hamsters without germline genetic engineering”的研究成果,该团队利用AAV表达功能获得性PCSK9突变体,开发了一种无种系基因工程的动脉粥样硬化诱导方法,该方法能快速诱导动物动脉粥样硬化。
随着基因编辑技术与病毒载体设计的发展,AAV在动物模型构建中的应用前景愈发广阔,如人源化疾病模型构建、神经退行性疾病建模、癌症研究模型构建、个体化医学研究等。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。