
前言
肌萎缩侧索硬化(ALS)是一种严重的进行性神经退行性疾病,主要累及中枢神经系统中的上、下运动神经元,导致进行性肌肉无力并最终危及生命,其确切致病机制至今尚未完全阐明,但多项研究表明,基因突变(如SOD1、FUS、C9orf72 等)、异常蛋白聚集、兴奋性毒性和神经炎症等因素都可能参与其中。尽管已有如利鲁唑(Riluzole)和依达拉奉(Edaravone)等药物,以及靶向SOD1、TDP-43 等基因的疗法陆续出现,目前仍缺乏从根本上减缓或逆转 ALS 病程的有效手段。
近年来,铁依赖的细胞程序性死亡形式——“铁死亡”(ferroptosis)尤为受到关注,因为其在运动神经元的退变过程中扮演了关键角色。在“铁死亡”(ferroptosis)过程中,过量铁会促进活性氧(ROS)的产生,从而氧化细胞膜上的多不饱和脂质(例如磷脂),形成各种氧化磷脂,其中就包括氧化磷脂酰胆碱(PC-OxPL)。这些氧化磷脂会在膜结构中累积并引发细胞膜损伤,进一步加剧神经元功能障碍或死亡。
近日,来自 VectorY Therapeutics、Tisch MS Research Center of New York 以及加州大学圣地亚哥分校等多家单位的研究团队在预印本平台(bioRxiv)上发布了一项新研究,提出利用 AAV 递送抗PC-OxPL的抗体片段,用以阻断 ALS 患者脑脊液和脑组织中富集的 PC-OxPL 所导致的神经毒性,从而保护运动神经元并抑制 TDP-43 的异常聚集。该研究为包括 ALS 在内的神经退行性疾病提供了新的干预思路,也展示了 AAV 基因疗法在复杂神经系统疾病应用中的潜力。

一、研究亮点
二、研究思路
三、主要研究结果
研究者对ALS患者的脑脊液和脑组织进行定量检测,发现多种氧化磷脂PC-OxPL大量富集(文章图1)。尤其是在脊髓腹角运动神经元区域,PC-OxPL与乙酰胆碱转移酶(ChAT)阳性细胞共定位,提示它与运动神经元损伤密切相关。
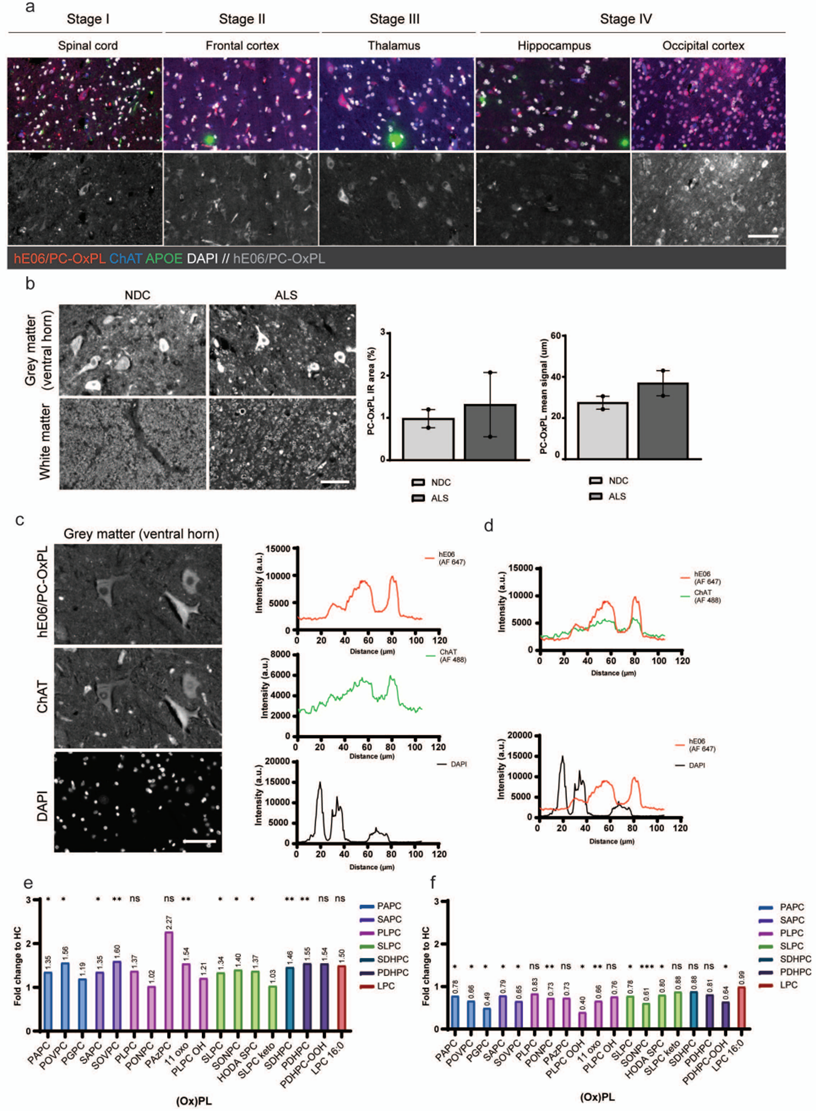
文章图1. PC-OxPL在ALS患者的大脑和脊髓中积累。a. 使用hE06全长抗体检测的PC-OxPL病理学代表性图像,展示了ALS病理学和进展的不同阶段特征。b. 左图:ALS患者和非痴呆对照组(NDC)脊髓中PC-OxPL积累的代表性图像。右图:通过红外(IR)面积和平均信号强度定量分析ALS患者和非痴呆对照组(NDC)脊髓中PC-OxPL的积累。c. 左图:脊髓灰质区域中PC-OxPL与ChAT共定位的代表性图像。右图:脊髓灰质区域中hE06/PC-OxPL与ChAT或DAPI共定位的线性分析。d. hE06/PC-OxPL与ChAT(上图)和DAPI(下图)的共定位分析。e. 与健康对照(HC)相比,ALS患者脑脊液中各(氧化)PC种类的浓度变化(Fold-change, FC)。f. 与健康对照(HC)相比,ALS患者血浆中各(氧化)PC种类的浓度变化。
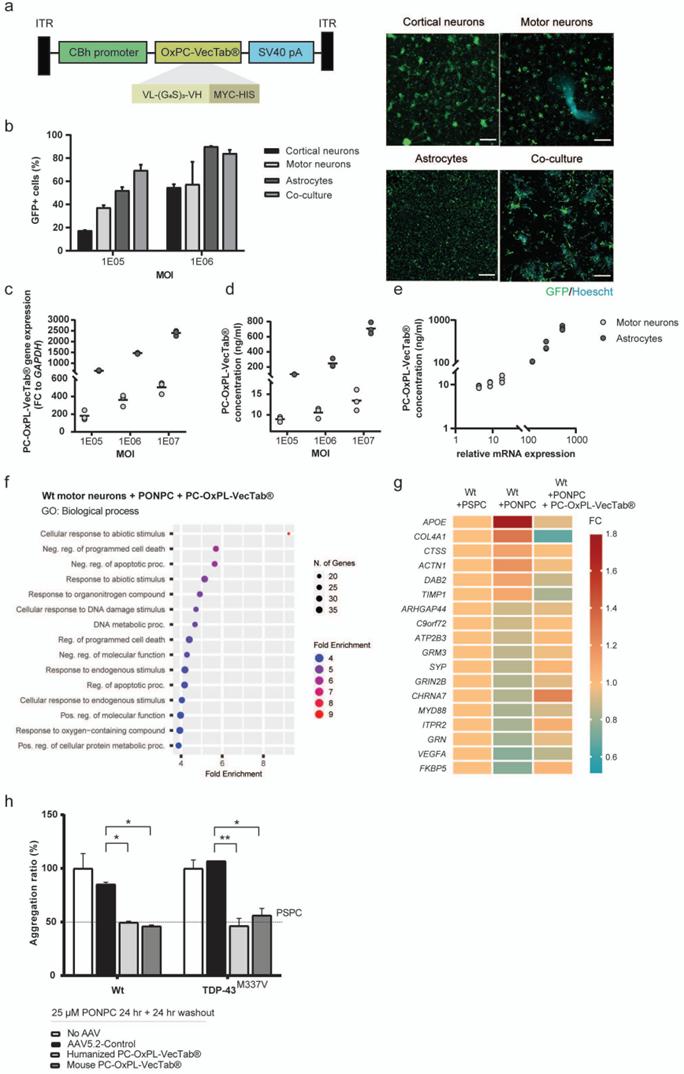
文章图4. 靶向PC-OxPL的PC-OxPL-VecTab®,阻断iPSC衍生运动神经元的神经毒性。a. AAV5.2-CBh-PC-OxPL-VecTab®载体结构示意图(ITR:反向末端重复序列;CBh:CBA杂合启动子;SV40 pA:猴病毒40多聚腺苷酸化信号)。b. AAV5.2-GFP在人源细胞中的趋向性差异:包括皮层神经元、运动神经元、星形胶质细胞以及运动神经元-星形胶质细胞共培养。c.AAV转导后运动神经元和星形胶质细胞中PC-OxPL-VecTab®转录本的表达:两种类型细胞均使用不同MOI的AAV5.2-Control进行转导,并在转导后第8天收集细胞裂解液。d. AAV转导后运动神经元和星形胶质细胞中PC-OxPL-VecTab®的蛋白表达:两种类型细胞均使用AAV5.2-CBh-PC-OxPL-VecTab®进行转导,并在转导后第8天收集细胞外培养基。e. 运动神经元和星形胶质细胞中PC-OxPL-VecTab®转录本表达与蛋白浓度的相关性分析:两种细胞类型均使用不同MOI的AAV5.2-Control进行转导,并在转导后第8天收集细胞裂解液。f. AAV5.2-PC-OxPL-VecTab®转导野生型运动神经元后,暴露于PC-OxPL(PONPC)的基因表达网络分析:分析中使用了“神经炎症”和“神经病理学”两组数据。所有通路按富集倍数(Fold Enrichment)排序。g. AAV5.2-Control转导野生型运动神经元后,暴露于PC-OxPL(PONPC)的转录组恢复情况的热图展示。h. 野生型和TDP-43 M337V运动神经元转导小鼠或人源AAV5.2-PC-OxPL-VecTab®后,暴露于PSPC或PC-OxPL的TDP-43聚集情况:TDP-43聚集以HTRF TDP-43实验测量的聚集比值表示。
在sALS脑脊液小鼠模型中,通过将PC-OxPL-VecTab®注射至颈椎蛛网膜下隙,能有效中和PC-OxPL的毒性,原本因sALS脑脊液暴露而引起的运动神经元中PC-OxPL水平升高、运动功能障碍和神经元退化均得到改善,同时轻微的神经炎症也趋于正常(文章图5)。
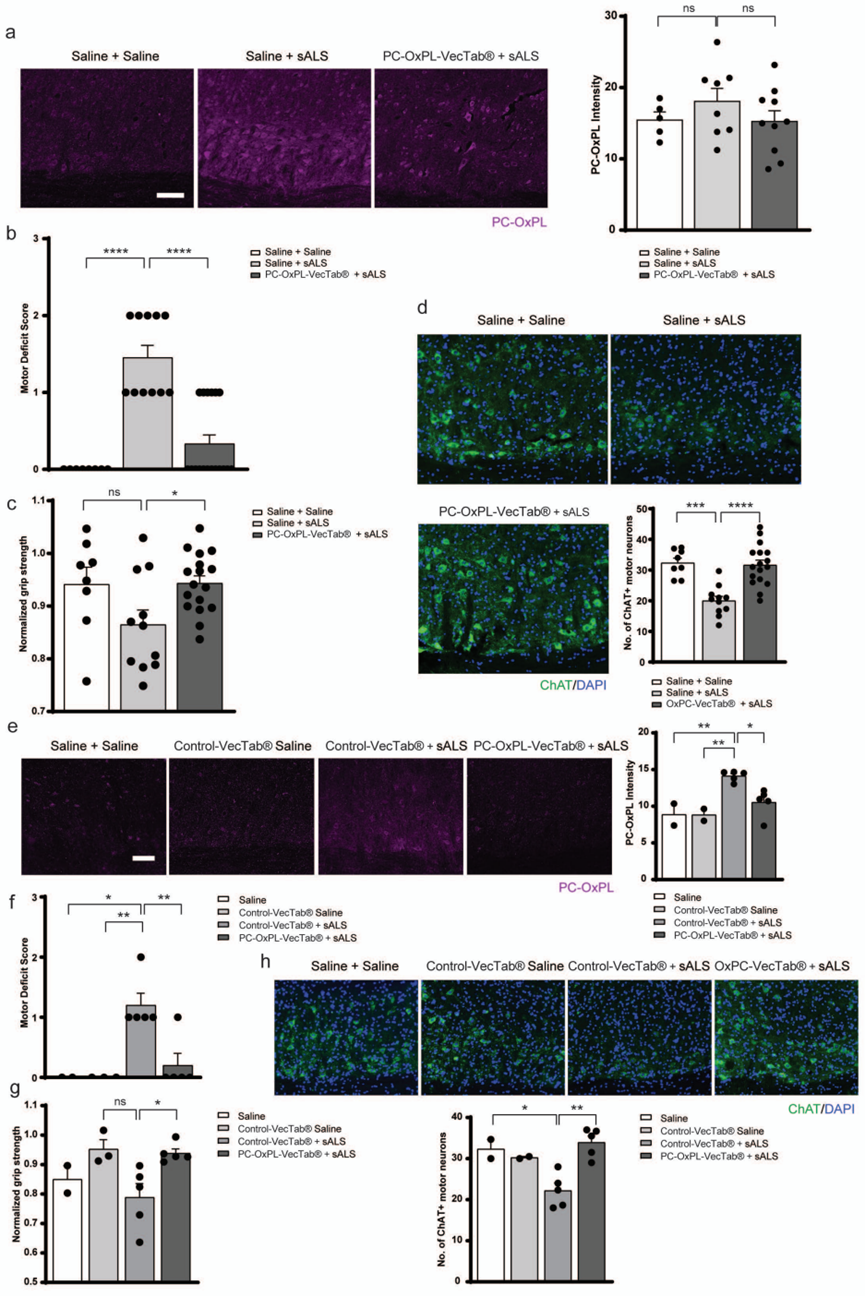
文章图5. PC-OxPL-VecTab®减轻sALS脑脊液诱导的运动功能障碍和运动神经元退化。a. 左图:小鼠硬膜外注射生理盐水或sALS脑脊液后1天,颈椎脊髓的PC-OxPL免疫染色代表性图像。小鼠在sALS脑脊液注射前4周接受了生理盐水或AAV5.2-PC-OxPL-VecTab®的硬膜外注射。右图:在sALS/生理盐水注射后1天以及AAV5.2-PC-OxPL-VecTab®注射后4周,颈椎前角灰质中PC-OxPL免疫染色强度的定量分析。b. 运动缺陷评分和c. 前肢握力的标准化力量:小鼠在硬膜外注射生理盐水或sALS脑脊液后1天的测量结果。小鼠在sALS脑脊液注射前4周接受了生理盐水或AAV5.2-Control的硬膜外注射。d. 上图:小鼠在硬膜外注射生理盐水或sALS脑脊液后1天,颈椎脊髓的ChAT免疫染色代表性图像。下图:在sALS/生理盐水注射后1天以及AAV5.2-PC-OxPL-VecTab®注射后4周,颈椎前角中ChAT+运动神经元数量的定量分析。小鼠在sALS脑脊液注射前4周接受了生理盐水或AAV5.2-PC-OxPL-VecTab®的硬膜外注射。e. PC-OxPL免疫染色强度的定量分析:在硬膜外注射生理盐水或sALS脑脊液后,颈椎前角灰质中的PC-OxPL免疫染色强度。f. 运动缺陷评分和g. 前肢握力的标准化力量:在硬膜外注射生理盐水或sALS脑脊液后,小鼠的测量结果。脑脊液在注射前预先与PC-OxPL-VecTab®或Control-VecTab®孵育。h. 上图:小鼠在硬膜外注射生理盐水或sALS脑脊液后1天,颈椎脊髓的ChAT免疫染色代表性图像。脑脊液在注射前预先与PC-OxPL-VecTab®或Control-VecTab®孵育。下图:在硬膜外注射生理盐水或sALS脑脊液后,颈椎前角中ChAT+运动神经元数量的定量分析。脑脊液在注射前预先与PC-OxPL-VecTab®或Control-VecTab®孵育。
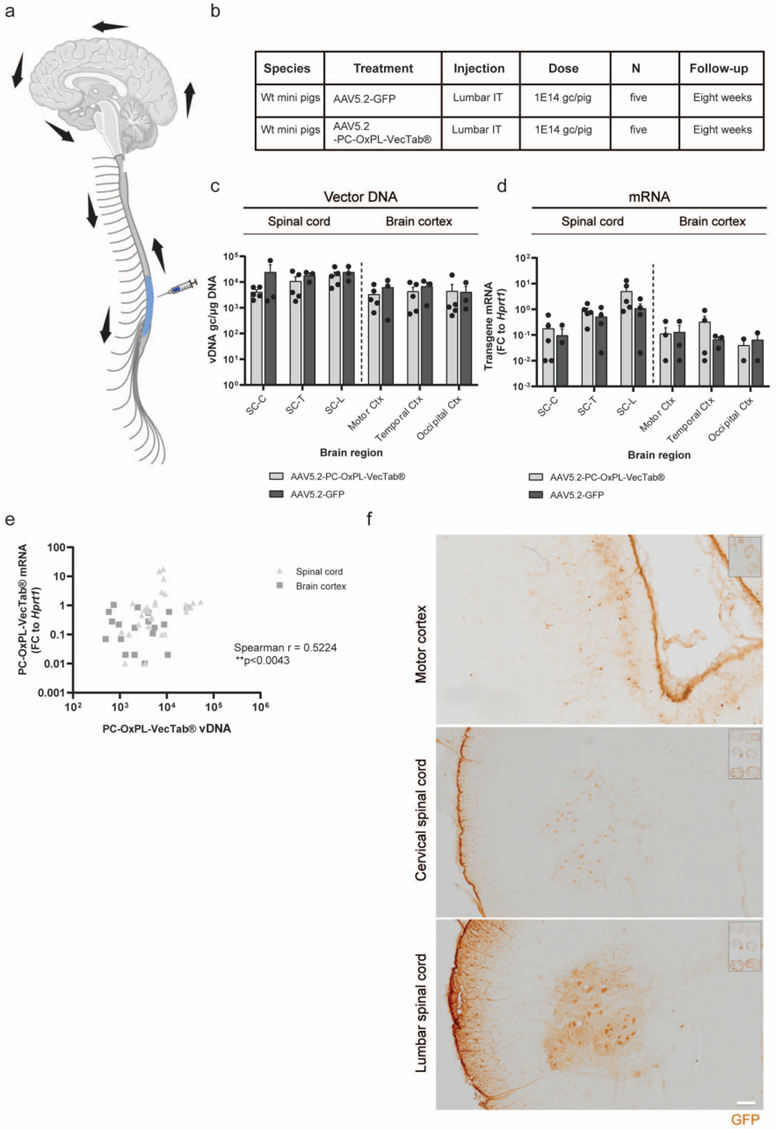
文章图6. 硬膜外给药后迷你猪大脑和脊髓中PC-OxPL-VecTab®的广泛分布。a. 脑脊液流动(箭头)示意图及硬膜外给药后AAV在中枢神经系统不同区域的分布。b. 研究设计及实验分组。c. AAV硬膜外给药后8周,脊髓和大脑皮层中载体DNA水平(基因组拷贝数/微克DNA)。d. AAV硬膜外给药后8周,迷你猪脊髓和大脑皮层中GFP或PC-OxPL-VecTab®转基因mRNA水平(以管家基因Hprt1为参照的倍数变化)。e. 迷你猪脊髓和大脑皮层中载体DNA与mRNA表达的相关性分析。f. 免疫组化检测硬膜外注射AAV-GFP后,迷你猪运动皮层(上)、颈椎脊髓(中)和腰椎脊髓(下)中的GFP蛋白。
四、总结和启示
- 定制化载体构建和AAV包装服务,可携带抗体片段(如scFv、Fab等)或其他治疗基因;
- 多种血清型AAV(包括AAV1–AAV9、AAVrh10等)及新型变体的高质量包装服务;
如需获取更多关于AAV-抗体递送、ALS基因疗法等的最新方案,欢迎联系派真生物,让我们携手加速ALS等神经系统疾病的转化研究与临床应用!
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

