
近年来,腺相关病毒(AAV)肝脏基因治疗发展迅速,其中AAV8、AAV5、AAV-LK03等血清型已在血友病等多种疾病的临床应用中展现出良好前景。然而,不同血清型在人体肝脏中的转导特性往往难以准确预测,尤其是当肝脏存在脂肪变性(steatosis)等病理状况时,传统的动物模型和体外检测手段往往无法充分模拟真实的人体环境。
近日,美国加州大学旧金山分校(UCSF)的 Holger Willenbring 教授团队在《Nature Biotechnology》上发表最新研究,通过机械灌注(Normothermic Machine Perfusion)在体外维持正常及脂肪变性人类肝脏的活性,对多种 AAV 血清型进行筛选,发现了更适合用于人类肝脏精准治疗的AAV血清型,进一步推动了个性化肝脏基因治疗的发展。

AAV-LK03:在人肝细胞中的高效特异转导
研究团队选取了AAV8、AAV5、AAV-LK03、AAV6和AAV-NP59这五种常见或新兴的AAV血清型,将其以共注射的方式分别注入正常和脂肪变性的离体人肝脏组织。随后,通过单细胞RNA测序(scRNA-seq)、免疫荧光和数字PCR等多种技术手段,系统评估了这些血清型在肝脏不同细胞亚型(如肝细胞、内皮细胞、Kupffer细胞等)中的转导效率和特异性。结果显示,AAV-LK03 在人肝细胞中表现出“高效率+高特异”的突出优点,显著优于目前常见的 AAV8 、AAV5和AAV6,以及在免疫缺陷小鼠中表现出色的 AAV-NP59;而 AAV5 虽整体转导效率偏低,却在脂肪变性肝脏中意外呈现出对中央静脉周围(pericentral)肝细胞的更强靶向性,这对急性间歇性卟啉病和Crigler-Najjar综合征等以肝门为中心的区域性病变疾病有潜在的应用价值。
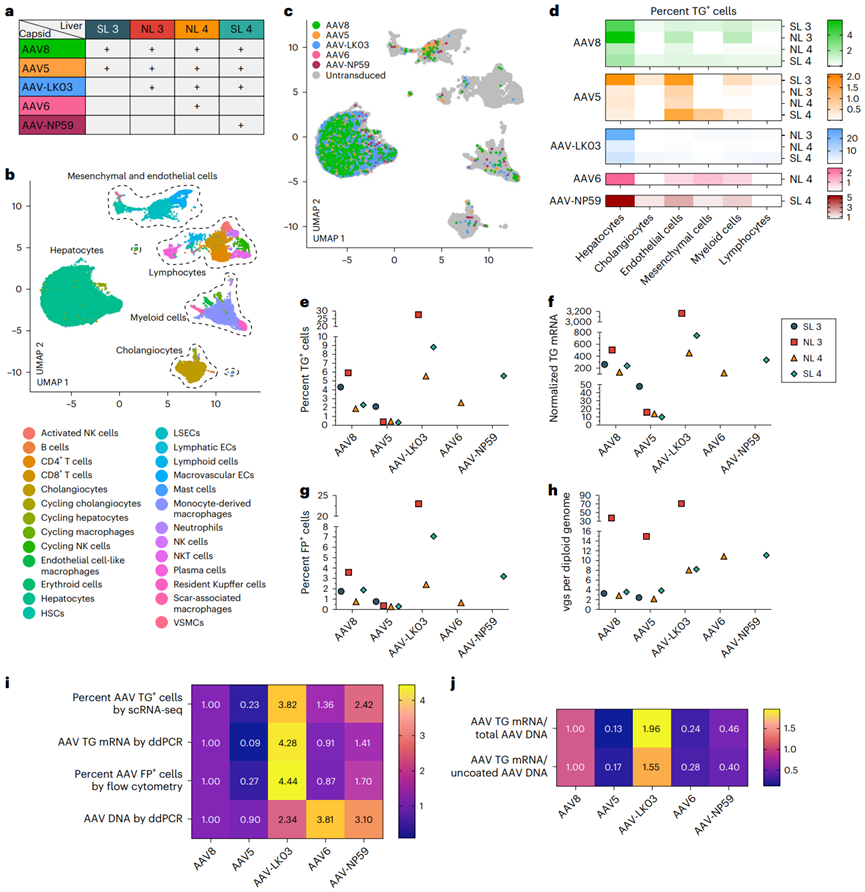
文章图2 AAV8、AAV5、AAV-LK03、AAV6 和 AAV-NP59在正常和脂肪变性人肝脏中转导肝细胞的效率和特异性比较。a. 将各种血清型AAV注射至人肝脏进行比较。SL3接受的注射剂量为3.4×10¹³ vgs/血清型,NL3接受的注射剂量为5.5×10¹² vgs/血清型,NL4 接受的注射剂量为 6.7×10¹¹ vgs/血清型,SL4 接受的注射剂量3.0×10¹² vgs /血清型。其中,由于 AAV6 是低产的血清型,所以NL4 注射的总剂量较低。b. 通过单细胞 RNA 测序分析来自四个肝脏的 35,807 个细胞的 UMAP 图,按细胞类型聚类;其中,ECs 为内皮细胞,LSECs 为肝窦内皮细胞,HSCs 为肝星状细胞,VSMCs 为血管平滑肌细胞。c. 不同血清型AAV转导细胞的 UMAP 图。d. 热图显示不同细胞群体中AAV的转导百分比。e、f. 通过单细胞 RNA 测序(e)和数字 PCR(f)定量分析AAV转基因 mRNA 表达的肝细胞。g. 通过流式细胞术定量分析AAV 荧光蛋白阳性的肝细胞。h. 使用数字PCR对肝细胞中每个二倍体基因组所含的 AAV 载体 DNA(vgs)进行定量分析。i. 热图显示五种 AAV血清型的 mRNA、蛋白和 DNA 水平,以 AAV8 为基准进行标准化,并取四个肝脏的平均值。j. AAV 转基因 mRNA 与总 AAV 载体 DNA 的比值(上排),AAV 转基因 mRNA 与未包被的细胞核AAV载体DNA的比值(下排),这些值均以 AAV8 为基准进行标准化,并取四个肝脏的平均值。
除了在肝细胞中的显著差异,本研究还首次揭示了不同AAV 血清型在Kupffer细胞、肝窦内皮细胞(LSECs)等非实质细胞中的转导谱。AAV5 和 AAV8 在肝窦内皮细胞方面表现出较高的转导效率,为血友病 A 等一些凝血因子主要在内皮细胞合成的疾病提供了更多选择,也为扩展更多靶点奠定了基础。
未来,随着对正常肝脏和病变肝脏研究的不断深入,不同AAV血清型与病理状态之间的相互关系将逐渐清晰。研究人员或可通过优化机械灌注条件、改造 AAV 衣壳或在给药前后对肝脏微环境加以干预等多种手段,提高基因疗法在脂肪变性等复杂病理环境中的疗效,真正实现个性化精确治疗。
基于研究结果,研究团队提出以下四项推进人类肝脏基因治疗的建议:
1.优先选择 AAV-LK03 衣壳,这样可以在肝细胞中实现高效且特异性的转导,有助于降低载体剂量,并尽量减少肝毒性风险和载体基因组整合的风险。
2.根据疾病特点实施针对性治疗
- 在正常肝脏中,使用 AAV-LK03 靶向肝门区肝细胞。
- 在脂肪变性肝脏中,使用 AAV5 靶向肝中央区肝细胞或肝窦内皮细胞(LSECs),以提升治疗效果。
3.在临床试验设计中重视转基因表达的持久性,例如,在脂肪变性肝脏中,AAV 载体的游离体形成受到一定程度的损害,需要在方案中予以特别考虑。
4.利用人肝常温机械灌注(NMP)的近临床环境,开发新的 AAV 衣壳,使其能以最高效率和特异性转导肝细胞或其他与治疗相关的细胞类型,从而适用于更多患者的需求。
本研究中用到的AAV载体的特征如下表:
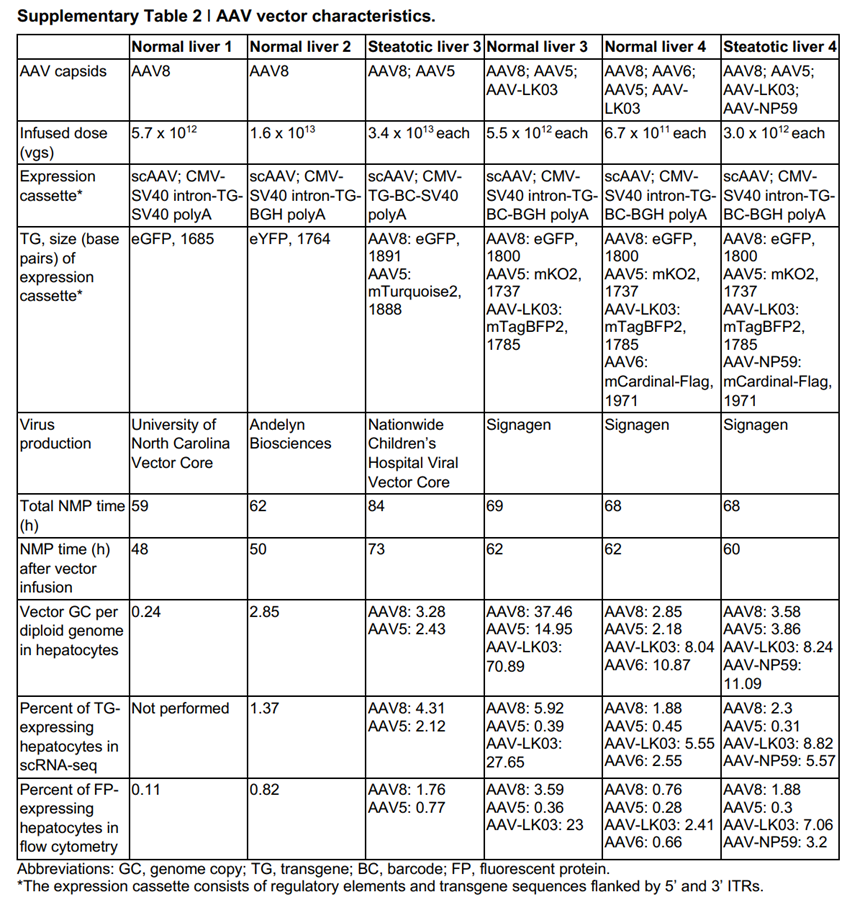
值得注意的是本研究中用到了携带eGFP、eYFP、mTurquoise2(一种亮青色荧光蛋白)、mKO2(一种改良的橙色荧光蛋白)、mTagBFP2(一种改良的蓝色荧光蛋白)、mCardinal-Flag(带有Flag标签的远红/近红外荧光蛋白)和barcode的AAV,派真生物可为您提供携带多种荧光蛋白和barcode的AAV,助力您筛选获得适合您实验的最佳AAV血清型。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

