
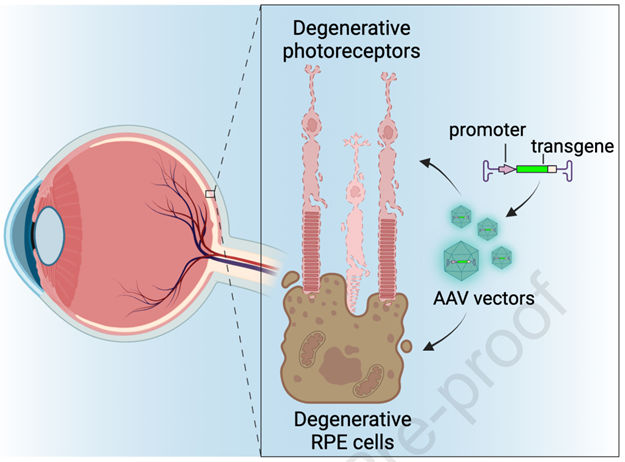
腺相关病毒(AAV)已成为眼科基因治疗的主要平台,并在临床应用中取得了显著成果。首个眼科基因治疗药物Luxturna已获批上市,用于治疗RPE65相关的莱伯先天性黑蒙(LCA)。然而,AAV基因治疗的开发仍面临诸多挑战,包括免疫反应、载荷容量有限,以及如何提高玻璃体内递送时的感染效率等。我们将以最近发表在Molecular Therapy杂志(IF=12.4)上的一篇综述为参考资料,讨论AAV眼科基因治疗的临床研究进展,重点关注针对遗传性视网膜疾病和获得性病症的临床试验,探讨免疫反应带来的限制和改善AAV载体性能的新策略。

基因治疗已成为治疗人类疾病的重要手段,其核心是向目标细胞内递送或修改遗传物质。主要方法之一是基因替代疗法,通过将功能正常的基因拷贝引入细胞,恢复因缺陷基因导致的功能丧失。与此相对,基因沉默疗法(也称RNA干扰疗法,RNAi)通过小RNA分子抑制或沉默有缺陷基因的表达,用于治疗因毒性功能获得性突变导致的疾病。
近年来,随着成簇规律间隔短回文重复序列(CRISPR)/Cas9技术的创新,基因编辑疗法成为一种可行的基因治疗方式。碱基编辑和先导编辑技术的发明进一步推动了这一领域的进展,这些方法能够在不诱导双链断裂的条件下直接修改DNA。此外,改良的CRISPR系统也被开发出来,使短暂的RNA编辑成为可能。基因表达还可以通过DNA甲基化、组蛋白修饰以及micro RNA来进行表观遗传调控。
针对特定类型突变,正在开发一些新兴策略,例如通过抑制性tRNA来治疗由无义突变引起的遗传性疾病。
无论采取何种策略,基因治疗都可以分为体外和体内两种实施方式。体外基因治疗是指从患者体内分离目标细胞,在体外对其进行遗传修饰后再回输到患者体内;而体内基因治疗则直接将遗传物质递送至目标组织。
在基因递送平台中,rAAV因其低致病性、广泛的组织嗜性以及较高的递送效率,成为许多基因治疗方法的首选体内递送载体,并在实验室研究和临床试验中得到广泛应用。
眼睛具备多种特性,使其成为基于rAAV基因治疗的理想靶标:
- 眼睛与身体其他部分相对隔离,这有助于载体局限于目标区域;
- 眼睛体积较小,所需的载体剂量较少;
- 眼睛容易接触,便于递送载体;
- 眼睛的免疫豁免地位能保护载体免受宿主免疫反应的影响;
- 眼睛可以方便地通过成像技术进行观察和评估,例如视网膜电图技术可以用于功能测量,以验证基因治疗的效果;
- 在同一实验动物的双眼之间可以设置治疗组和对照组,进一步提高了研究的可控性。
以上这些优势使眼科基因治疗药物Luxturna™(voretigene neparvovec-rzyl)成为首个获得美国食品药品监督管理局(FDA)批准的基于rAAV的治疗方法,标志着这一领域的重要突破。自此之后,基于rAAV的基因治疗陆续在多种适应症中获批,包括脊髓性肌肉萎缩症、芳香族L-氨基酸脱羧酶缺乏症、杜氏肌营养不良症、血友病A型和血友病B型等。
AAV是一种小型、无包膜的病毒,具有一个由60个亚基组成的二十面体衣壳(图1a),其基因组为4.7 kb的ssDNA分子。wtAAV的基因组由 cap 和 rep两个基因组成,两端由ITRs包围。ITRs在病毒生命周期中的复制和包装过程中起着关键作用。在rAAV基因治疗中,病毒的基因被移除,使载体丧失复制能力,同时最大限度地增加可包装用于基因替代、沉默、编辑或调控的DNA容量。
AAV载体的嗜性由其衣壳决定,这是因为衣壳表面的氨基酸残基能够与宿主细胞上的受体相互作用。衣壳蛋白与目标细胞特定受体的结合直接影响病毒进入和转导细胞的能力。此外,衣壳还是中和抗体(NAbs)的主要靶标。这些抗体由宿主的适应性免疫反应产生,可以与病毒结合并阻止其进入细胞。这些NAbs可能是宿主因接触AAV载体而产生的,也可能是宿主曾经接触过自然存在的AAV而存在的预存抗体。
眼睛是一个免疫豁免环境,能够避免循环NAbs的干扰,这使得AAV载体在宿主体内能够以非整合的游离体形式长期存在并持续表达转基因。然而,在某些情况下,AAV递送的基因可能会整合到宿主基因组中,这种整合通常发生在染色体上的AAVS1位点,但其发生频率非常低。
在进行基因治疗时,我们关注的基因(Gene of interest , GOI)及其调控元件(比如启动子和聚腺苷酸信号)需要适应rAAV基因组的容量限制,这个容量大约是4.5kb,并且这些元件需要被放置在必需的ITRs之间(图1b)。
不同的AAV血清型源自腺病毒库或灵长类动物的组织,它们各自具有特定的细胞或组织趋向性(图1c)。例如,AAV2和AAV8因能够有效感染视网膜细胞,常被用于视网膜基因递送。然而,决定其嗜性的结构与功能关系尚未完全阐明。除了衣壳的物理特性外,AAV的转导效率还受细胞表面受体的表达与修饰、细胞内运输、入核以及第二链DNA合成速率的影响。
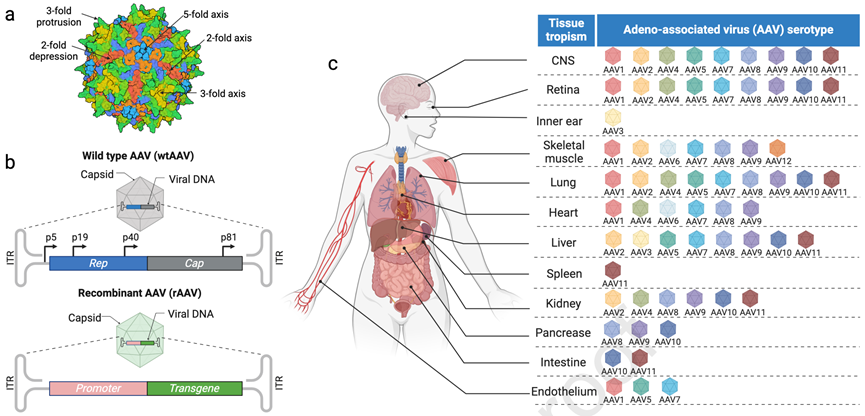
图1 AAV衣壳结构、基因组以及组织嗜性特点。a. AAV衣壳表面模型显示了其二十面体的2重、3重和5重对称轴。b. 野生型AAV(wtAAV)和重组AAV(rAAV)的基因组结构。在wtAAV基因组中,Rep78和Rep52基因的转录分别由p5和p19启动子调控,这些转录本经过选择性剪接后可生成两个较短的转录本,即Rep68和Rep40。此外,Cap基因的转录由p40启动子调控,Cap转录本同样通过选择性剪接生成三种病毒结构蛋白:VP1、VP2和VP3。而rAAV基因组则通过将病毒基因替换为含有目标基因的表达盒构建,该表达盒由两个ITRs(用于DNA复制和包装的必需顺式元件)包围。rAAV的生产依赖于提供Rep、Cap以及腺病毒辅助基因功能。c. 自然存在的AAV血清型的组织嗜性分布。CNS:中枢神经系统。
AAV介导的基因递送是一个复杂的过程,其起点是病毒衣壳与目标细胞表面的特定受体结合,这一结合主要由衣壳的结构决定。不同的AAV血清型常用的受体各不相同,例如,AAV2依赖肝素硫酸蛋白多糖(HSPG),AAV1、AAV4、AAV5和AAV6则主要结合唾液酸,而AAV9则倾向于N-连接的半乳糖。此外,还有一些共同受体(如整合素和成纤维细胞生长因子受体)可能参与病毒的附着和细胞进入。
AAV衣壳上的受体结合位点在决定病毒的细胞和组织嗜性中起着至关重要的作用,因此成为提高目标细胞转导效率的重要改造对象。近年来的全基因组筛选研究表明,除了糖类受体,许多宿主蛋白也在rAAV细胞进入中发挥重要作用。其中,I型跨膜蛋白KIAA0319L被鉴定为AAV的普遍受体(AAVR),对大多数rAAV的转导过程至关重要。此外,GPR108也被发现是几种rAAV血清型的重要细胞进入因子。研究表明,尽管敲除AAVR或GPR108对rAAV与细胞表面的结合影响不大,但这些蛋白在病毒进入过程中的后续步骤中不可或缺,对于实现有效的转导尤为关键。
rAAV衣壳首先附着于细胞表面,随后通过依赖于clathrin和caveolin的内吞机制,或与这些机制无关的内吞途径,被吞入细胞内,进入内质网。随着内质网的成熟及其环境的酸化,rAAV衣壳发生构象变化,从而能够逃离内质网进入细胞质,并避免被降解。
AAV的微小尺寸使其能够通过核孔复合体完整地进入细胞核,并在释放其单链DNA基因组前保持完整状态。为了实现基因表达,病毒的单链DNA必须在宿主细胞的酶作用下转化为双链形式,这一步通常是限制转导效率的关键步骤。为了解决这一问题,一些rAAV被设计为具有自互补基因组,从而加速双链DNA的形成。然而,这种设计会使rAAV的基因组包装能力减少一半。最终,治疗性基因从双链DNA模板中被转录和翻译,从而发挥其功能。
尽管rAAV通常引发的先天免疫反应较弱,且在给药后很少观察到细胞因子的显著表达,但其适应性免疫反应可能非常强烈,常导致抗病毒衣壳或GOI表达产物的NAbs生成,这种免疫反应可能显著削弱治疗的效果,因此在选择血清型和设计载体时,需要格外关注如何最大程度地降低其免疫原性。
rAAV在眼科基因治疗中具有显著优势:
- 眼睛独特的免疫豁免环境,加上rAAV低免疫原性的特点,可以有效避免强烈的天然免疫反应,从而将不良反应的风险降到最低。
- rAAV能够靶向多种视网膜细胞,包括光感受器、视网膜色素上皮(RPE)和视网膜神经节细胞。目前,已经开发出多种工程化的AAV衣壳,可以针对特定细胞类型实现更高效的转导。
- rAAV的小尺寸也使其能够更有效地穿透视网膜层,适合用于眼底注射和玻璃体内注射。
- 眼睛体积较小,显著降低了临床级rAAV的生产和治疗成本,与用于更大区域(如大脑)或需要全身给药的治疗策略相比,眼科基因治疗在经济和技术上更具可行性。
AAV2是目前眼科基因治疗中研究和应用最广泛最广的血清型之一,它对视网膜细胞表面的HSPG具有很高的亲和力,因此能够高效感染几乎所有类型的视网膜细胞。而且,AAV2通过不同的给药方式可以靶向不同类型的细胞,因此已成功应用于多项临床试验,包括治疗莱伯先天性黑蒙(LCA)和脉络膜病变的研究。
除了AAV2,其他常用的血清型还有AAV5和AAV8,它们各有特点和优势。AAV5在人群中的血清阳性率较低,因而更不容易受到NAbs的阻断。一项Ⅰ/Ⅱ期临床研究表明,通过眼底注射AAV5-hRKp.RPGR至患有XLRP-RPGR(X连锁视网膜色素变性)的男性患者,安全和耐受性良好,同时能够改善视网膜敏感性和功能性视力,这为后续的Ⅲ期临床试验奠定了基础。而AAV8通过眼底注射时,表现出比AAV2更高效的光感受器转导能力。
近年来,衣壳工程的进步推动了新型AAV血清型的开发。这些新型血清型具有更高的转导效率、更低的免疫原性以及更强的目标视网膜细胞特异性。例如,工程变体AAV2.7m8和Anc80在临床前研究中展现了比其天然血清型更强的感染能力。AAV2.7m8已获得监管批准,用于治疗年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME)。该血清型可以通过玻璃体内注射实现对特定视网膜细胞的靶向,较眼底注射而言侵入性更小,操作更为便捷。这一进展揭示了新型工程化衣壳在基因治疗中的潜在应用价值。
在rAAV设计中,选择合适的启动子和调控元件是关键环节。这些元件需要在眼睛的特定细胞类型中,以适当的水平驱动转基因表达。细胞特异性启动子,如视紫红质启动子适用于杆状光感受器,而G蛋白偶联受体激酶1(GRK1)启动子则适用于视杆细胞和视锥细胞。这类启动子能够最大限度地减少脱靶效应,同时提升治疗效果。对于视网膜色素上皮细胞(RPE),可以选择RPE65或bestrophin 1(BEST1)启动子来驱动基因表达。而在需要广泛且稳定的基因表达场景中,则通常采用广谱启动子,例如巨细胞病毒(CMV)启动子、鸡β-肌动蛋白(CBA)启动子或混合CBA启动子(CAG)。
目前, rAAV眼科基因治疗主要采用眼底注射的方式进行给药,这种方法可以将rAAV递送到光感受器和RPE,这些外层视网膜细胞类型与许多遗传性视网膜疾病(IRDs)的发病密切相关。眼底注射的优势在于能够相对直接地接触目标细胞,然而,这一给药方式对技术要求极高,需要经验丰富的外科医生,同时伴随高昂的时间和经济成本,以及复杂的后勤安排。此外,在注射过程中形成的手术泡可能增加视网膜脱离的风险,特别是在视网膜已经退化的患者中。由于手术泡的空间有限,rAAV只能感染有限数量的光感受器和RPE细胞,从而导致转导效率受限。
相较之下,玻璃体内注射是一种相对简单且安全的递送方式,可实现rAAV在视网膜中的广泛分布。这种方法可以在临床诊所环境中完成,降低了治疗的成本和复杂性。然而,与眼底注射相比,其临床应用的一个关键障碍在于感染仅限于内层视网膜。这主要是因为内限制膜(ILM)作为玻璃体和视网膜之间的屏障,其富含HSPG,与rAAV2衣壳结合紧密,限制了载体的扩散。为了解决这一问题,通过修改衣壳以降低其与HSPG的结合亲和力,可以增强rAAV穿过内层视网膜并扩散至外层视网膜的能力,从而提高对外层视网膜细胞的转导效率。
目前,衣壳工程主要有两种方法:理性设计和定向进化。此外,其他策略如分离自然变体以及人工智能(AI)辅助衣壳设计,也在开发适合玻璃体内注射、能够高效转导光感受器的衣壳变体中发挥了重要作用。
01 理性设计
随着人们对rAAV结构和生物学特性的深入研究,一种针对AAV衣壳基因中特定位点的复杂合理设计方法应运而生。研究表明,表皮生长因子受体蛋白酪氨酸激酶能够磷酸化rAAV2衣壳表面的某些特定残基,从而触发rAAV2的泛素化和蛋白酶体降解。为了克服这一限制,科学家将rAAV2衣壳蛋白VP3上的三个表面暴露的酪氨酸(Y)残基替换为苯丙氨酸(F)残基(Y444F/Y500F/Y730F),这一改造显著增强了rAAV2在中枢神经系统(CNS)中的转导效率。此外,进一步的改造组合(Y272F/Y444F/Y500F/Y730F/T491V,称为QuadYF+TV)在小鼠视网膜中的转导效率也得到了显著提升。经过玻璃体内注射后,QuadYF+TV AAV2载体能够转导多达25%的光感受器细胞,而野生型AAV2则无法实现对光感受器的转导。然而,这些突变具体如何促进外层视网膜细胞中转导效率的提升,目前仍不完全清楚。
近期的一项研究表明,经过理性设计的衣壳变体AAVv128与AAV8(与之具有99%的序列相似性)相比,在转导效率和视网膜组织分布范围上均显著提高。采用眼底、玻璃体或脉络膜上注射等不同给药方式,AAVv128均能够有效靶向光感受器和RPE细胞。此外,AAVv128在抑制新生血管性年龄相关性黄斑变性(AMD)的脉络膜新生血管形成方面表现出了优越的效力。冷冻电镜分析进一步揭示了AAVv128衣壳的独特结构特征,这些特性可能与其结合能力增强、核摄取效率提高及内质网逃逸能力改善密切相关。
02 定向进化
定向进化是一种优化rAAV衣壳的方法,目的是让rAAV具有更好的性能,比如更高的产量、转导效率(即能更有效地将基因导入细胞),或者能更特异性地靶向某些细胞或组织。这一过程通过在rAAV衣壳中插入随机短肽,能够在较短且可控的时间内完成rAAV性能的优化。
研究表明,一定程度的HSPG结合对于rAAV2的扩散是必要的,然而,过强的HSPG结合可能导致载体被困在ILM中,阻碍其向视网膜外层扩散。在一项研究中,研究人员通过在AAV2衣壳的N587三重对称轴突出区域插入随机7肽,构建了一个用于小鼠玻璃体内注射的rAAV库。经过多轮筛选,最终鉴定出一个名为7m8的AAV2变体,该变体在小鼠中表现出显著的光感受器和RPE细胞感染能力,同时在非人灵长类动物(NHPs)中也能实现有限的光感受器感染,预示着其在人体中的潜在应用前景。此外,研究还发现,一个结合了AAV2.7m8和QuadYF+TV修饰的嵌合型rAAV2,与单独突变的rAAV2相比,对小鼠内层视网膜细胞和光感受器的转导效率显著增强。这些结果为进一步优化rAAV在基因治疗中的应用提供了重要的依据。
另一项研究采用相似的方法,将多种rAAV2衍生文库混合后通过玻璃体内注射到NHPs的眼睛中。经过六轮筛选,研究人员鉴定出一种名为AAV2-LALIQDSMRA的变体。这种变体能够以高滴度包装(约5.0×10^¹³ vg/mL),并在RPE中显著富集。与之前在小鼠中筛选出的变体7m8相比,AAV2-LALIQDSMRA感染视网膜神经节细胞的能力较弱,但对光感受器的感染能力更强,达到了7m8的11.71倍,表明其在灵长类动物光感受器中的嗜性更高。
与上述研究有所不同,Büning团队首先在体外对AAV2-7-肽文库进行了HSPG结合的反筛选(即选择HSPG结合能力较弱的变体),然后通过静脉注射至小鼠体内,筛选富集于光感受器的AAV2变体。经过三轮筛选,最终鉴定出两种变体:AAV2.GL和AAV2.NN。这两种变体在小鼠、犬类和NHPs的玻璃体内注射后,均表现出强烈且广泛的视网膜转导能力。
此外,Boye团队结合定向进化与理性设计方法,对基于AAV2骨架的病毒库进行了两轮筛选,并对六个表面暴露的可变区域进行了突变筛选,最终分离出一种名为P2-V1的衣壳变体。该变体通过玻璃体内注射展现出增强的视网膜细胞感染能力,并能够有效逃避人类玻璃体样本中的NAbs。与AAV2和7m8相比,P2-V1表现出更优越的特性。
尽管这些工程化载体在小型动物模型中被证实是安全且高效的,但在大型动物中实现类似效果通常需要10-100倍的剂量,这是由于大型动物的眼球体积和表面积比例较大,并且需要跨越更长的扩散距离。这种剂量依赖性增加了视网膜潜在毒性的风险,需要在应用中谨慎考虑。
定向进化技术用于小鼠模型中筛选具有组织靶向性更强的AAV衣壳,已成功鉴别出多个有名的衣壳变体,在中枢神经系统(CNS)和视网膜的转导能力显著增强。然而,后续研究表明,某些变体,如AAV.PHP.B和AAV.PHP.eB虽然在小鼠中展现了出色的CNS转导效果,但在NHPs中表现不佳。这种差异至少部分归因于这些载体与小鼠特有受体(如Ly6a)的相互作用。Ly6a受体仅在小鼠脑内皮细胞中表达,而人类无Ly6a受体,因此限制了这些变体在临床应用中的转化潜力。同样,AAV2.7m8变体通过玻璃体内注射在小鼠中表现出优异的光感受器感染能力,但在NHPs中效果有限,仅在黄斑和周边区域观察到少量视网膜感染,光感受器的感染效率非常低。这些结果再次凸显了AAV载体在跨物种应用开发中所面临的挑战。
为了克服这一问题,近期的研究逐渐转向在NHPs中开展筛选工作,因为NHPs在遗传和生物学上与人类更为接近。例如,最近一项研究利用注射多种AAV衣壳库的NHP眼睛中的体内数据,设计了一种新的人工智能(AI)优化AAV衣壳。该衣壳与AAV2相比,视网膜转导效率提高了80倍,与其它人工工程化衣壳相比也提升了2.6倍,同时在NHP模型中显示出更低的眼部炎症反应。类似地,另一项研究开发了两种新的AI优化AAV衣壳,分别为AVT260和AVT239。这两种衣壳通过玻璃体内注射,在NHPs中实现了更高的视网膜转导效率。其中,AVT260的转导效率比AAV2.7m8提高了5倍,AVT239则提高了2倍。这些成果展示了通过在更接近人类的模型中开发新型AAV载体的潜力,有望推动AAV在基因治疗领域的进一步应用。
03人工智能辅助设计
人工智能(尤其是机器学习)作为一种新兴的数据驱动技术,正在AAV衣壳工程领域迅速发展。
在一项开创性研究中,研究人员利用机器学习技术发现了新的AAV衣壳变体。他们通过分析AAV2衣壳的单密码子替换、插入和删除,对其适应度进行了全面审查,揭示了衣壳表面暴露和隐藏残基的重要信息。基于这些关键信息,研究人员运用机器学习设计出包含多个突变的衣壳变体,并通过按每个残基对目标组织递送效果的比例进行采样,大大减少了需要筛选的变体数量,相比传统的随机突变方法更加高效。此外,同一团队还利用深度学习技术设计了更多样化且具有实际可行性的AAV2衣壳变体,重点研究了衣壳中561-588位置区域。尽管数据有限,这一方法仍成功预测了不同变体的衣壳活性。这一策略不仅深化了对经典区域(如N587)的认识,还扩展到了AAV基因的其他区域,为开发更多样化的衣壳变体提供了可能,为未来新型AAV的设计提供了重要启发。
另一项研究进一步展示了机器学习在AAV衣壳工程中的潜力。利用机器学习引导设计的AAV衣壳变体,通过玻璃体内注射后,在NHPs的神经视网膜中的转导效率比传统rAAV2高出80倍,能够高效转导视杆细胞、视锥细胞、小胶质细胞和视网膜神经节细胞。此外,研究人员创建了一个多样性高的AAV文库,并在小鼠体内以及人类细胞中进行了筛选,以筛选理想的基因治疗载体,如具有更高的包装能力和特定组织的嗜性等。这些实验数据随后被用于训练机器学习模型,成功预测了猕猴中AAV衣壳变体的生物分布。这些研究结果展示了机器学习模型在指导AAV衣壳设计中的重要作用,不仅为优化NHP研究提供了新路径,还为首次人体临床试验中的AAV开发奠定了基础。
AAV作为眼科基因治疗的主要平台,在临床试验中取得了显著成果,但仍面临诸多挑战,相信通过不断优化载体设计和递送技术,AAV将在眼科基因治疗领域发挥更大的潜力。派真CRO &CTDMO 一站式服务平台,提供从基因合成、载体构建,到病毒包装的整体解决方案,全面支持您基因编辑研究,还可提供从研究至GMP级别的多种AAV血清型载体,助力眼科疾病基因治疗。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

