
- 什么是慢病毒
慢病毒是以HIV-1为基础改造而来的一种病毒载体。在数十年的应用中,慢病毒载体的生物安全性和有效性不断被提升,目前已经成为体内外生物实验中一种功能非常强大的基因递送工具。
在基因递送方面,慢病毒载体拥有诸多独特的优势:稳定持久表达、可感染多种类型细胞、可携带大片段基因、免疫原性比较低等。无论是基础科研还是临床应用,慢病毒载体都具有非常广泛的应用前景。
- 慢病毒的应用场景
目前慢病毒载体主要应用在以下几个方面:
- 细胞基因治疗(已上市的CAR-T产品有9款采用了慢病毒载体递送CAR基因)
- 基因表达调控(过表达、RNA干扰研究等)
- 基因编辑(CRlSPR/Cas9 gRNA文库筛选、基因敲除、敲入、点突变、基因激活/抑制)
- 稳转细胞株构建
- 活体细胞成像追踪
- 转基因动物
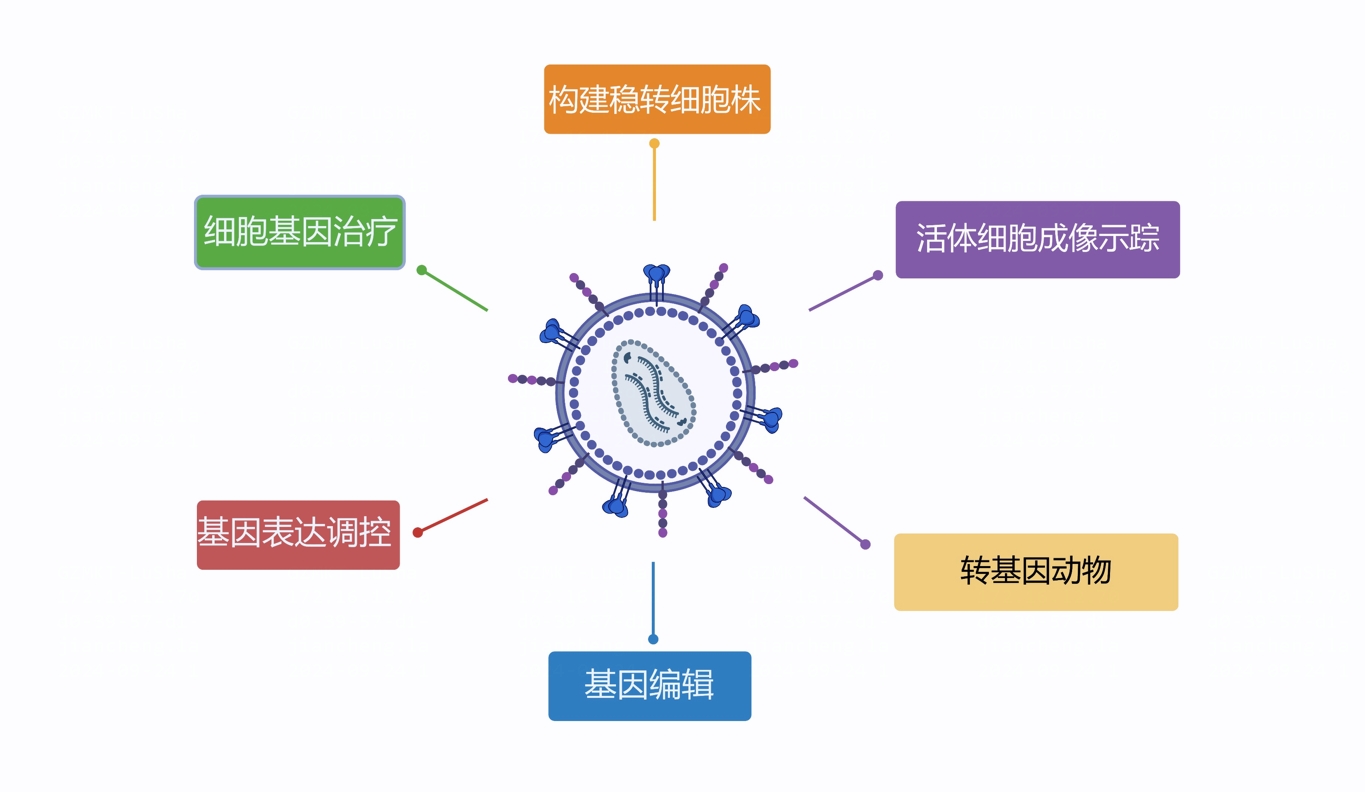
图1 慢病毒载体的主要应用方向
由于高氧消耗,心肌细胞对环境中的氧气极为敏感。脯氨酸羟化酶结构域蛋白2(PHD2)是一种氧气传感器,对细胞缺氧适应性至关重要。近年来的研究发现,PHD抑制剂(PHIs)和针对PHD2的小干扰RNA(PHD2shRNA)可以在不影响细胞能量水平的情况下激活AMPK,将细胞缺氧信号转化为能量代谢信号,使细胞产生能量保护反应,并显著提高细胞对缺氧的抵抗力。研究还发现,信号分子钙(Ca2+)在响应缺氧的AMPK信号通路激活中发挥着重要作用。然而,PHD活性如何增加细胞内Ca2+水平并激活AMPK信号通路的分子机制仍然不清楚。

实验设计和主要研究结果:
- 确认PHIs 诱导心肌细胞中的钙释放。
- PHD2 在心肌细胞中激活肌浆网通道辅助蛋白 CaMKⅡ。用shRNA干扰技术敲低心肌细胞中PHD2,Western blot证实了PHD2的沉默。与对照细胞相比,沉默PHD2显著增加了CaMKⅡ的磷酸化。
- Ca2+ 在心肌细胞中介导 PHI 刺激引起的 AMPK 激活。肌浆网通道抑制剂瑞安诺丁显著降低了PHI处理诱导的与Ca2+相关的荧光强度。慢病毒介导的RyR2特异性shRNA显著降低了RyR2在mRNA水平上的表达。此外, IP3R阻断剂2-APB预处理或慢病毒介导的IP3R特异性shRNA均未显著影响PHI处理诱导的P-AMPK水平。2-APB预处理对PHI诱导的Ca2+荧光也无显著影响。这些结果表明,PHI诱导的钙释放和AMPK激活主要由肌浆网通道而非IP3R通道调节。
- CaMKⅡ介导PHI诱导的钙释放和AMPK激活。PKA不参与PHI/Ca2+/AMPK信号通路,而CaMKⅡ在PHI/Ca2+/AMPK信号通路中发挥着重要作用。
- TRPA1介导PHI/Ca2+/AMPK信号通路的激活。TRPA1抑制剂HC030031预处理显著抑制了PHI诱导的P-AMPK和P-CaMKⅡ增加,并显著减少了PHI诱导的Ca2+荧光。PHD2 shRNA组中TRPA1蛋白水平显著高于对照组。这些结果强烈表明TRPA1在PHD诱导的Ca2+释放途径中发挥着至关重要的作用。
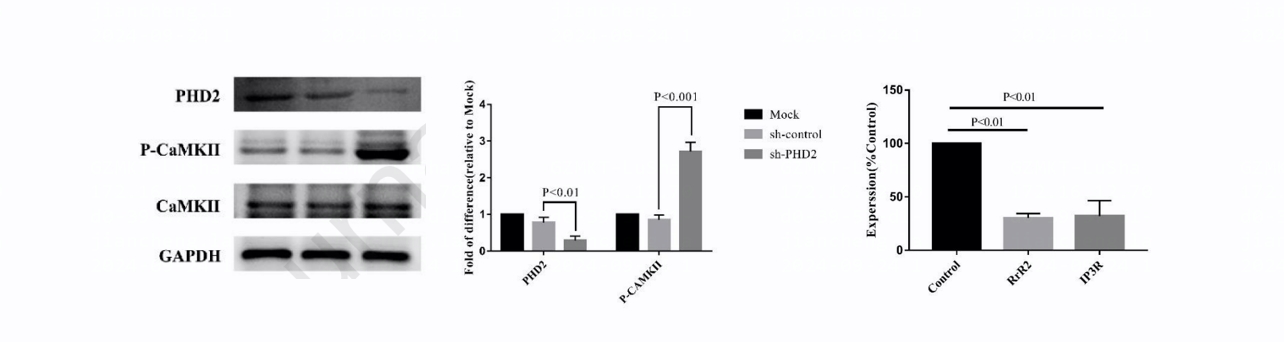
图3 慢病毒介导的特异性shRNA对 PHD2、RyR2和IP3R的敲低效果
| 载体信息 | pLV.U6. PHD2shRNA.CMV.copGFP-2A-Puro.WPRE
pLV.U6. RyR2shRNA.CMV.copGFP-2A-Puro.WPRE pLV.U6. IP3RshRNA.CMV.copGFP-2A-Puro.WPRE |
| 感染细胞 | H9C2 |
| 调控方式 | 敲低PHD2、RyR2和IP3R |
派真生物有幸为以上研究提供慢病毒。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

